自身免疫性肝炎(autoimmune1hepatitis,lAIH)是一类以自身免疫反应为基础,l以高丙种球蛋白血症、i高血清自身抗体(autoantibody)为特征的肝脏炎症性病变。汇管区大量浆细胞浸润并向周围肝实质侵入形成界板炎症是其典型病理组织学特征。此病多见于女性(男女比例为1:i3.6),l任何年龄均可发病。如不治疗易发展为肝硬化,l免疫抑制剂对其显示一定疗效。
【病因及发病机制】
自身免疫性肝炎的病因及发病机制尚不清楚,l遗传易感性被认为是主要因素,l而病毒感染、i环境和药物则可能是在遗传易感基础上的促发因素。
表达在肝细胞表面的肝特异性膜蛋白——去唾液酸糖蛋白受体(ASGP-R)以及微粒体细胞色素P4502D6(CYP2D6)目前被认为是相对较明确的激发AIH的抗原。抗原被抗原递呈细胞递呈到细胞表面与HLAⅡ类分子结合,l进而被T细胞受体(TCR)识别并激活T细胞的过程受编码HLA分子的MHC等位基因多态性的影响。位于HLAⅡ类分子抗原结合槽上DRβ多肽链第67~72位氨基酸序列,l尤其是第71位氨基酸的位置与AIH的发生有重要关联,l因为第71位氨基酸位于抗原结合槽的顶端,l其位置决定HLA与抗原结合以及进而被TCR识别的能力。编码该氨基酸序列的MHC等位基因在不同人群间存在着差异,l具有AIH遗传易感倾向的北欧及北美人第67~72位氨基酸序列为Leu-Leu-Glu-Gln-Lys-Arg,l其中第71位氨基酸为赖氨酸(Lys),l编码该序列的MHC等位基因为DRB1.0301、iDRB3.0101和DRB1.0401。具有AIH遗传易感倾向的DR4阳性日本人的第71位氨基酸为精氨酸(Arg),l其编码基因为DRB1.0405。其他不同地域人群也有各自的HLA遗传易感特点。除HLA外,lTCR、iVDR、iTLR-4、iTGFβ等在遗传上的差异也都可能影响AIH的易感性。
激活的CD4+T细胞(包括Th1和Th2)通过T-B细胞膜的直接接触以及释放细胞因子刺激B细胞产生针对自身抗原的抗体,l启动免疫损伤反应。此外细胞因子还通过激活CD8+T细胞介导ADCC效应杀伤肝细胞,l激活TNF或Fas系统介导肝细胞凋亡,l激活星形细胞促进肝纤维化的发生。AIH患者多表现Ts功能缺陷,l其逃逸免疫耐受的机制尚不明确。
【病理】
汇管区大量浆细胞浸润,l并向周围肝实质侵入形成界板炎症是其主要病理特征。肝小叶内可见点状或碎片状坏死,l病情进展时也可出现桥接坏死甚至多小叶坏死。汇管区炎症一般不侵犯胆管系统,l无脂肪变性及肉芽肿。除最轻型炎症外,l几乎所有AIH都存在不同程度的纤维化,l严重病例可出现肝硬化。当应用免疫抑制剂(immunodepressant)治疗有效时,l炎症改变可恢复至正常或局限在汇管区,l即使已发展为肝硬化也可恢复至静止期。
上述病理改变虽有一定特征,l但并非特异,l有时不易与慢性病毒性肝炎、i药物性肝炎、i暴发性Wilson病鉴别。AIH/PBC重叠综合征的血清学表现为AMA阳性,l病理学以AIH的特征为主。AIH/PSC重叠综合征时AMA阴性,l病理学以PSC的特征为主。
【临床表现】
AIH起病多缓慢,l类似慢性病毒性肝炎,l约30%的病例类似急性肝炎,l但急性肝功能衰竭少见。多数患者有小关节疼痛症状,l除此之外主要表现为乏力、i食欲减退以及程度不同黄疸等慢性肝病的非特异性表现。肝肿大常见,l半数病人表现为脾肿大。同其他慢性活动性肝病一样,l若病情未得到控制,l也可逐渐进展为肝硬化,l甚至并发肝癌。合并肝外表现时,l多提示疾病处于活动期。
【实验室检查】
AIH患者的转氨酶水平一般较胆红素和碱性磷酸酶升高更明显,l血清γ球蛋白和IgG升高是一主要特征,l儿童还可出现不完全性IgA缺乏。自身抗体检测对AIH的诊断具有重要价值,l其效价代表自身免疫反应的强度,l分析某些抗体的动态变化水平有助于评价病情和指导治疗。
(一)自身抗体常规检测
1.抗核抗体(ANA)及平滑肌抗体(SMA)11为1型AIH的特征性抗体。ANA可与多种细胞核抗原反应,l但尚未发现针对哪一种核抗原的ANA对AIH的诊断具有特异性,l其单独出现率为13%,l与SMA的共同出现率达54%。
SMA可与多种细胞骨架成分反应,l包括抗肌动蛋白(anti-actin)及非肌动蛋白抗体,l其单独出现率为33%。除1型AIH外,lANA及SMA也可见于PBC、iPSC、i慢性病毒性肝炎、i药物性肝炎、i酒精性及非酒精性肝病以及某些自身免疫病。
2.1型肝肾微粒体抗体(anti-LKM1)11为2型AIH的特征性抗体,l一般不与ANA及SMA同时出现。该抗体于体外可识别微粒体细胞色素P450酶系2D6分子(CYP2D6)的4个特定重组线性序列。约5%慢性丙型肝炎患者血清中也可存在低水平的anti-LKM1,l其原因可能是由于HCV核心区与CYP2D6存在分子模拟现象,l但丙型肝炎出现anti-LKM1的几率在地域上存在差异(常见于欧洲而很少见于北美),l故推论宿主CYP2D6蛋白表达在个体间的差异以及HCV基因序列的地域差异都影响抗原激发机体免疫反应的能力。
3.抗中性粒细胞胞浆抗体(pANCA)11见于绝大多数ANA及SMA阳性AIH,l但不具有诊断特异性,l可见于多种疾病。
(二)自身抗体补充检测
在常规抗体分析后仍不能明确诊断时,l可进一步分析如下抗体。
1.抗肌动蛋白抗体(anti-actin)11较SMA对1型AIH的诊断更具特异性,l但敏感性不如SMA,l故不能在常规诊断中替代SMA。易见于HLA-DR3阳性者,l发病年龄早,l对免疫抑制剂治疗反应差。
2.抗1型肝细胞溶质抗原抗体(anti-LC1)11对2型AIH的诊断较特异,l而且监测血清变化规律还有助于评价病情及指导治疗。此外由于该抗体很少见于丙型肝炎患者,l因此检测该抗体还有助于AIH与丙型肝炎的鉴别。
3.抗可溶性肝抗原抗体(anti-SLA)/抗肝胰抗体(anti-LP)11对AIH的诊断具有高度特异性,l见于3型AIH。患者常为HLA-DR3阳性者,l抗体于治疗消失后再现预示复发。
4.抗去唾液酸糖蛋白受体抗体(anti-ASGPR)11见于85%未经治疗的活动性AIH患者,l可与ANA和SMA或anti-LKM1共同出现,l除具诊断意义外,l对估价病情和观察疗效也有重要意义,l治疗有效时抗体水平下降乃至阴转,l复发时可再现。除AIH外,l少数急性病毒性肝炎、iPBC、i某些恶性肿瘤及其他自身免疫病也可出现anti-ASGPR,l偶也见于慢性病毒性肝炎和酒精性肝病等。
【诊断及临床分型】
(一)诊断
根据临床表现结合血清转氨酶和γ-球蛋白水平、i自身抗体以及组织学特征一般诊断并不难。对不典型病例需依据国际AIH协作组建立并经过多次修改的评分系统(见下表)。
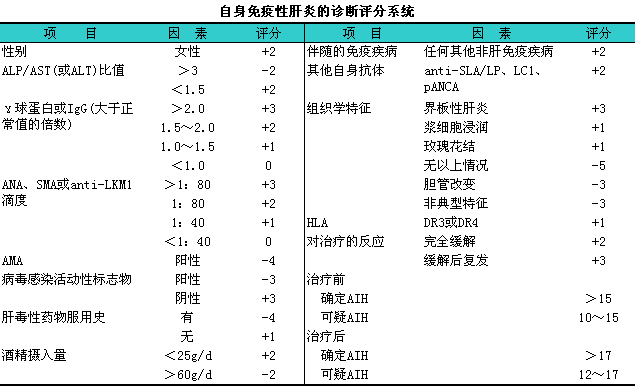
(二)临床分型
不同类型AIH有各自的临床表现及血清学特征。
1.1型11最常见,l分布无明显地域差异,l特征性抗体为ANA及SMA。任何年龄都可发病。多见于HLA-DR3(DRB1.0301)及DR4(DRB1.0401)阳性者,l其中DRB1.0301阳性者相对较年轻,l对免疫抑制剂治疗反应差,l停药后易复发;DRB1.0401阳性者年龄多偏大,l易合并甲状腺炎、i溃疡性结肠炎和类风湿关节炎等肝外自身免疫病,l对免疫抑制治疗的反应相对好。此型患者血清pANCA及anti-actin也可阳性。
2.2型11相对少见,l主要分布在欧洲和南美,l特征性抗体为anti-LKM1。患者多为20岁以下HLA-DRB1.0701阳性青少年或儿童,l易合并1型糖尿病、i甲状腺炎、i皮肤白斑病、i1型自身免疫性多腺体综合征等肝外表现。过去认为此型患者对免疫抑制剂治疗反应差,l现已认识到,l起病隐匿,l且进行性加重,l发现时多已出现肝硬化是此型患者对免疫抑制剂治疗反应相对较差的主要原因。2型患者的anti-LC1也可阳性。
3.3型11有人主张将该型归为1型,l认为两者的临床表现相似,l但多数研究者还是认为应该单独列出此型。anti-SLA/LP是此型特征性抗体,l对免疫抑制剂治疗反应良好是一重要临床特征。
4.重叠综合征11分A和B两型。A型包括AIH/PBC重叠综合征或自身免疫性胆管炎,l其中前者血清学检查与PBC相似,lAMA阳性,l但活体组织学检查符合AIH的特征,l对免疫抑制剂治疗反应好;后者AMA阴性,l但有其他自身抗体和PBC的病理特征,l对免疫抑制剂治疗的反应差。B型仅指AIH/PSC重叠综合征,lAMA阴性,l可存在自身抗体,l但活体组织学检查以及胆管造影显示PSC的特征。
【鉴别诊断】
应注意与PBC、iPSC、i慢性病毒性肝炎相鉴别,l此外也应注意遗传性肝脏疾病(Wilson病、iα1抗胰蛋白酶缺乏、i血色病)、i药物性肝病以及系统性红斑狼疮性肝损伤。
(一)与PBC及PSC的鉴别
三者的临床表现有相似之处,l且均易合并肝外自身免疫病,l故有时不易鉴别,l当出现重叠综合征时,l诊断更为困难。对有典型胆汁淤积表现及生化改变(ALP、iGGT升高)病人,l如AMA阳性和(或)组织学有典型改变即可诊断PBC;如胆管造影有胆管狭窄或扩张以及与正常胆管相间的串珠样改变并可除外肿瘤、i结石、i创伤、i手术等继发原因即可诊断PSC。对不具上述典型表现的病人,l则需依赖组织学特征及进一步的自身抗体分析进行鉴别。胆管损伤、i胆管周围纤维化及汇管区胆管消失更常见于PBC及PSC;自身抗体AMA有时可与AIH的特征性自身抗体共同出现,l但除AIH/PBC重叠综合征外,l单独出现时则对PBC的诊断更具有意义。
(二)与慢性病毒性肝炎的鉴别
AIH的多项表现包括高γ球蛋白血症、i自身抗体和肝外自身免疫现象也常见于慢性病毒性肝炎(尤其是慢性丙型肝炎),l而且AIH有时也可出现anti-HCV假阳性反应,l因此两者时常不易鉴别。血清中同时出现自身抗体、i类风湿因子以及冷丙球蛋白多提示为合并自身免疫现象的慢性丙型肝炎,l而非自身免疫性肝炎。5%慢性丙型肝炎患者血清中可出现ANA及SMA,l但两者一般不同时出现,l效价多较低。偶尔也可出现anti-LKM1和anti-LC1。HCV1RNA阳性是确证HCV感染的最可靠指标。
AIH与慢性丙型肝炎的鉴别诊断极其重要,l不恰当地使用干扰素治疗可使AIH恶化,l而盲目应用免疫抑制剂又可加重丙型肝炎患者的病毒血症。
【治疗】
(一)免疫抑制剂治疗
治疗主要选择免疫抑制剂,l最常用的免疫抑制剂为糖皮质激素,l可单独应用也可与硫唑嘌呤联合应用。合理免疫抑制剂治疗的缓解率可达60~80%,l甚至可逆转肝纤维化,l使肝硬化患者的10年生存率达90%以上,l而且对合并黄疸、i食管静脉曲张破裂出血以及腹腔积液的活动性失代偿期肝硬化患者也有效。免疫抑制剂对非活动性肝硬化效果不佳。
1.适应证
(1)治疗的绝对适应证:i血清AST≥正常上限值10倍,l或≥5倍且γ-球蛋白≥正常上限值2倍;病理学检查有桥接坏死或多小叶坏死。
(2)治疗的相对适应证:i有乏力、i黄疸、i关节痛等症状,l血清AST及γ-球蛋白异常,l病理学检查存在界板炎症。对老年或绝经后出现骨质疏松、i未控制的高血压和糖尿病或既往有精神失常病史者,l在权衡利弊并能严密观察病情的前提下也可选用糖皮质激素治疗,l因为治疗后一般都可使病情得到不同程度的缓解。不能耐受免疫抑制剂治疗者预后较差。对AIH/PBC重叠综合征患者可加用熊去氧胆酸(UDCA)。
2.初治方案11单独应用泼尼松的第一周剂量为60mg/d,l此后每周减量10mg,l第5周起采用20mg/d的维持剂量直至病情缓解。与50mg/d硫唑嘌呤联合用药时,l泼尼松剂量减半。联合用药可最大限度地减少糖皮质激素的副作用,l更适用于存在激素治疗潜在危险者。
3.疗程11采用免疫抑制剂治疗2周后90%的患者血清转氨酶和γ-球蛋白的水平可有所改善,l3~6个月后病理学改变有所恢复,l但短期内很少达到病情缓解的指征。
病情缓解是指临床症状消失,l血清转氨酶及γ-球蛋白基本恢复至正常,l组织学检查无明显活动性炎症,l或仅有局限在汇管区的轻度炎症。部分患者可在治疗18个月后达到病情缓解的指征,l但80%的患者需经3年的维持治疗才能达到。临床和实验室检查是评价的主要依据,l不一定要有组织学恢复的证据。
长期应用硫唑嘌呤应警惕骨髓抑制。另外,l长期应用免疫抑制剂可增加并发肿瘤的危险,l应高度重视。
4.复发及复治11复发一般在停药后的2午内发生,lHLA-A1、iB8、iDR3单倍型者更易复发。对第1次复发者可重新选用初治方案,l但对第2次复发者则需调整治疗方案。复治的原则是采用更低剂量以及更长时间的维持治疗以缓解症状并使转氨酶控制在正常值5倍以下。
一般在采用泼尼松诱导缓解后每月减量2.5mg,l直至保持上述指标的最低剂量(多数患者的最低平均剂量为7.5mg/d)后进行长期维持治疗。为避免长期应用糖皮质激素的副作用,l也可在病情缓解后将泼尼松在每月减量2.5mg的同时增加硫唑嘌呤2mg/(kg·d),l直至单独应用硫唑嘌呤的最低维持量。此外也可采用联合治疗的最低剂量。
5.治疗失败后的处理11对经常规方案治疗后病情无缓解且进行性加重者可再行大剂量免疫抑制剂治疗。泼尼松单独应用的剂量可增至60mg/d,l与150mg/d硫唑嘌呤联合应用时的剂量为30mg/d,l至少一个月后逐渐减量。泼尼松每月减量10mg,l硫唑嘌呤每月减量50mg,l直至维持病情处于缓解状态的最低维持量。
对不能耐受硫唑嘌呤者可试用6-巯基嘌呤。对失败者也可试用环孢素、i熊去氧胆酸、i甲氨堞呤、i普乐可复(FK506)或吗替考酚酯(骁悉)。新型糖皮质激素布德松在肝脏首过效应中代谢较快,l其疗效并不优于泼尼松。
(二)肝移植
多数AIH对免疫抑制剂的反应较好,l但约有20%~40%的患者对免疫抑制剂治疗无效。出现肝功能失代偿时,l肝移植是最佳的治疗方法。
【预后】
AIH的预后差异较大,l自发缓解率低。免疫抑制剂治疗和肝移植是改善AIH预后的重要措施。
推荐阅读文献
1.Czaja1AJ,lFreese1DK;American1Association1for1the1Study1of1Liver1Disease.Diagnosis1and1treatment1of1autoimmune1hepatitis.Hepatology.20021Aug;36(2):i479-497
2.Alvarez1F,lBerg1PA,lBianchi1FB,let1al.International1Autoimmune1Hepatitis1Group1report:ireview1of1criteria1for1diagnosis1of1autoimmune1hepatitis.J1Hepatol11999;31:i929-938