抗菌药物不能有效的抑制细菌生长繁殖或杀灭细菌,l称为抗菌药物的耐药性。随着临床上抗生素的广泛使用,l细菌出现耐药性,l导致临床治疗失败。细菌耐药性分为固有耐药性和获得耐药性。细菌的固有耐药性与细菌的种属遗传有关,l如革兰阴性细菌对青霉素的耐药性,l肠球菌对头孢菌素、i林可霉素和磺胺类的耐药性,l它决定了抗生素的抗菌谱。获得耐药性是指细菌的个体由于发生了某些突变或从其他细菌中获得了某种决定性基因,l使原来不具有抗药性的细菌产生某种程度新的耐药性。获得耐药性是细菌常见的耐药方式,l主要通过:i①产生抗生素降解酶或修饰酶,l使抗生素进入细菌菌体之前失活或结构发生改变;②抗生素作用的靶位点发生突变,l使之不能紧密结合或不能结合;③细菌细胞壁通透性发生改变,l降低抗生素进入细菌细胞内的浓度;④细菌“外流泵”的作用,l降低抗生素在细菌细胞内的浓度。
(一)产生抗生素降解酶或修饰酶
1.β内酰胺酶 细菌通过产生β内酰胺酶降解β内酰胺类抗生素是最常见的耐药方式。使β内酰胺类抗生素的β内酰胺环内的环形胺键呈开环形式,l不能与靶位点结合,l失去抗菌活性。
在青霉素广泛应用以前,l人们就发现有一些细菌特别是金黄色葡萄球菌易降解苄青霉素而产生耐药。细菌产生的酶可以使青霉素结构中的β内酰胺环开环,l因此称为青霉素酶。20世纪50年代产青霉素酶的金黄色葡萄球菌是医院感染暴发流行的重要角色。从此,l类似的酶在革兰阳性和阴性菌耐药性的发生和扩展中越来越重要。由于它们的底物都是β内酰胺类抗生素,l因此被重新命名为β内酰胺酶。
细菌产生的β内酰胺酶的编码基因可以存在质粒上或染色体上。革兰阳性菌产生的β内酰胺酶可以通过细胞壁自由地从细胞内释放出来,l在菌体周围降解β内酰胺类抗生素,l降低了菌体周围的抗生素浓度。这些细菌的耐药性是一种群体耐药现象,l细菌数量越多产酶量越多,l因此大量细菌比少量细菌的耐药性要强的多。革兰阴性细菌的细胞壁外膜有阻挡β内酰胺酶通过的作用,l产生的β内酰胺酶存在于细胞膜和细胞壁外膜之间的胞周间隙中,l仅降解进入细菌体内的抗生素,l细菌的耐药性强弱与菌量多少无关。对革兰阴性细菌产生的β内酰胺酶的测定分析常需粉碎细菌体后才能进行。
β内酰胺酶种类繁多,l分子组成和功能特性各异。有多种分类方法,l常用的有Ambler法(依据分子结构特点),lRichmond和Sykes法(依据功能特性对革兰阴性菌的β内酰胺酶进行分类),lBush法(将分子组成和功能特性结合对β内酰胺酶进行分类)。常见β内酰胺酶的分类见下表。无论哪一种方法均不能完全合理的将所有β内酰胺酶归类。
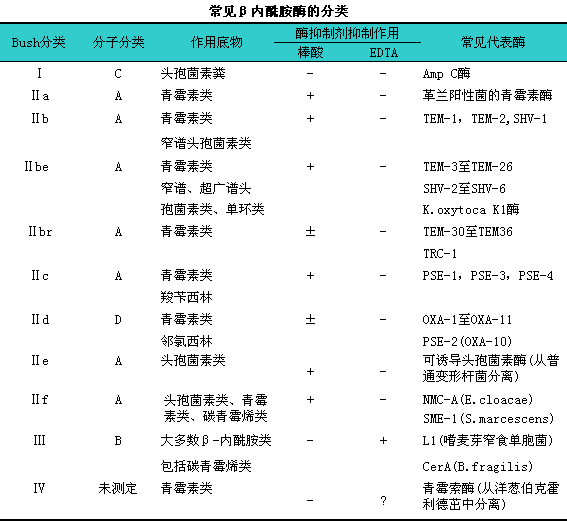
几乎所有的革兰阴性菌都可产生染色体介导的Ⅰ型β内酰胺酶,l是一种诱导酶,l即当诱导物存在时大量产酶,l去除诱导物则停止产酶或仅产极少量的酶。它们水解头孢菌素的速度是青霉素的11000倍,l但邻氯青霉素不被水解。β-内酰胺酶抑制剂对该类酶无明显抑制作用。Ⅰ型β内酰胺酶较多的存在于枸橼酸杆菌属、i阴沟肠杆菌、i沙雷菌属、i变形杆菌属、i大肠埃希菌,l也存在于假单胞菌属和不动杆菌属。可水解青霉素、i广谱青霉素、i头孢菌素、i单环类、i头霉素类等β内酰胺类抗生素.但不能水解碳青霉烯类、i第四代头孢菌素。过多使用第三代头孢菌素,l在临床治疗过程中将选择出去阻遏高产突变菌株,l出现高产Ⅰ型β内酰胺酶。β内酰胺酶抑制剂对其无效,l
Ⅱbe型β内酰胺酶又称超广谱β内酰胺酶(Extended-spectrumβ-lactamases,lESBLs),l是临床目前遇到的重要的耐药问题之一。
ESBLs是一大类基于TEM-1、iTEM-2和SHV-1型β内酰胺酶基础上经突变而成的多种β内酰胺酶,l在大肠埃希菌、i肺炎克雷伯菌最为常见,l其他肠杆菌科细菌和非发酵菌也存在。水解青霉素、i广谱青霉素、i头孢菌素、i单环类、i第四代头孢菌素,l但不能水解碳青霉烯类、i头霉素类。除了对β内酰胺类抗生素耐药外,l经常伴随对氨基糖苷类等其他抗生素的耐药性,l呈现多重耐药。β内酰胺酶抑制剂克拉维酸(棒酸)、i他唑巴坦和舒巴坦能有效抑制该类酶,l但TEM131~TEM146型β内酰胺酶对酶抑制剂耐药。各型酶对不同抗生素的作用效率是不同的,l如头孢噻肟是CTX-M型β内酰胺酶的最好底物,l水解很快,lSHV-4型对头孢噻肟、i头孢他啶和氨曲南的水解速率有很大的差别,l2EM13、iTEM-4型和sHv_4、iSHV-5型对头孢噻肟和头孢他啶的水解效率差不多,l而TEM-10和TEM-26型因为对头孢他啶的水解速率明显高于其他氧亚氨基β内酰胺类抗生素,l被称为头孢他啶酶。因此在测定未知种类的β内酰胺酶时,l应至少同时使用两种以上的抗生素作为底物。
分子类别为B的β内酰胺酶具有二价金属阳离子活性中心,l可以水解大多数β内酰胺类包括碳青霉烯类。主要在非发酵菌、i嗜麦芽窄食单胞菌、i厌氧菌、i蜡样芽胞杆菌和少数肠杆菌科细菌中存在。酶抑制剂不能抑制,lEDTA、i巯基乙醇等金属离子螯合剂可抑制其活性。
2.氨基糖苷修饰酶 有三种修饰氨基糖苷类抗生素的酶:i乙酰基转移化酶(AAC)、i磷酸转化酶组(APH)和腺苷酸转化酶(ANT)。他们的作用位点、i氨基酸不同的序列和对不同种类氨基糖苷类抗生素的作用总结如下:i
AAC修饰氨基糖苷类抗生素的氨基组,l最重要的是AAC(3)和AAC(6')。AAC(3)修饰位于氨基糖苷类抗生素中央的氨基环醇环3号位点上的氨基基团,lAAC(2')是乙酰基转移化酶修饰在4号位换环的2号位上的氨基。所有类型的AAC(3)均修饰庆大霉素。AAC(6')Ⅰ型有9种基因型,l对妥布霉素、i阿米卡星、i奈替米星、i卡那霉素、i新霉素等均产生水解作用,l但对庆大霉素敏感;该酶可以单独存在,l但更多的是与AAC(3)Ⅱ、iANT(2'')Ⅱ酶在一起,l形成庆大霉素、i妥布霉素和卡那霉素共同耐药。
APH和ANT修饰氨基糖苷类抗生素的羟基组,lAPH(3’)Ⅰ和Ⅱ水解卡那霉素和新霉素,l对阿米卡星不降解;APH(3')Ⅲ和Ⅳ水解卡那霉素、i新霉素和阿米卡星,l庆大霉素、i妥布霉素、i奈替米星、i安普霉素无作用基团。
APH(2'')水解卡那霉素、i妥布霉素、i庆大霉素,l阿米卡星
和奈替米星不水解,l新霉素和安普霉素无作用基团。
ANT(41')(4'')水解卡那霉素、i新霉素、i阿米卡星、i妥布霉素,l庆大霉素、i奈替米星、i安普霉素无作用基团。
ANT(2'')水解卡那霉素、i妥布霉素、i庆大霉素,l不水解阿米卡星和奈替米星,l新霉素和安普霉素无作用基团。
3.大环内酯类、i林可霉素和链阳霉素修饰及灭活酶11由于革兰阴性杆菌的外膜蛋白对大环内酯类、i林可霉素和链阳霉素(MLSB)的通透性很低,l而导致先天耐药。革兰阳性细菌可通过靶位点修饰酶或灭活酶的作用产生耐药。
(1)靶位点修饰酶:iMLSB具有共同的作用位点,l结合在50S核糖体亚基上抑制肽链的延长。对MLSB耐药的菌株通常获得l个耐红霉素的甲基化酶(erm)基因,l该基因编码1个特异的使23S1rRNA腺嘌呤末端N6甲基化酶,l导致核糖体构型变化.降低与所有MLSB抗生素的亲合力,l产生耐药。可以通过诱导产生MLSB耐药。也可以通过质粒介导和传播。
(2)灭活酶:i耐药菌株产生有ere1A和ere1B基因编码的红霉素酯酶,l或通过磷酸化转移酶使大环内酯类结构中的Lactone环消失,l破坏大环内酯类抗生素而产生耐药。ere1B基因通常和erm1B基因在一起,l导致红霉素高度耐药.此外某些菌株产生3-林可霉素-4-克林霉素-O-核苷转移酶对林可霉素和克林霉素耐药。
4.氯霉素灭活酶细菌通过获得性的乙酰化酶使氯霉素形成1-乙酰化氯霉素和1,l3-乙酰化氯霉素,l不能与50S核糖体亚基结合抑制细菌的肽链转移酶,l而产生耐药。
(二)抗生素作用的靶位点发生突变
抗生素作用于细菌的某特定位点,l使其不能发挥正常功能,l导致细菌代谢停止或细胞结构缺陷而死亡。细菌通过对特定位点的突变,l改变了结合位点的结构,l或产生了新的不能与抗生素结合的替代物质,l或产生了保护性的物质阻止了抗生素的结合而逃避抗生素的作用。
金黄色葡萄球菌由于获得了1个额外的mac1A基因,l编码产生具有转肽酶功能的PBP12a,l可以替代其他PBP的功能,l并且与β内酰胺类抗生素亲和力极低。当β内酰胺类抗生素与细菌正常存在的PBP结合后,lPBP12a发挥功能使细胞壁合成继续进行,l从而对所有β内酰胺类抗生素耐药,l形成耐甲氧西林金黄色葡萄球菌(MRSA);其他葡萄球菌也可获得mac1A基因,l形成同样的耐药性。肺炎链球菌由于嵌合基因编码了存在修饰的青霉素结合蛋白PBP1a、i2b、i2x,l降低了与β内酰胺类抗生素亲和力,l这些PBP基因均有多位点的突变。肠球菌的PBP5与青霉素的亲和力较低,l使肠球菌具有先天性青霉素低度耐药。由于PBP5的氨基酸突变替代使与青霉素的亲和力降低,l产生青霉素高度耐药。
此外棱糖体的突变在氨基糖苷类抗生素的耐药菌株中也经常发现。四环素耐药的菌株中发现了核糖体保护蛋白TetM、iO、iP、iQ和S,l存在于许多菌株中阻止四环素与核糖体结合而产生耐药。
对氟喹诺酮类药物的耐药主要是由于gyrA和parC基因突变。而对万古霉素的耐药主要是细菌获得了另外的合成酶VanA和VanB以及其它系列酶如VanH、iX、iY、iZ等。
(三)外膜通透性改变和主动外排
革兰阴性细菌的外膜中存在外膜蛋白通道,l如大肠埃希菌的OmpF和OmpC表达的改变,l数量和比例的变化可降低β内酰胺类抗生素的敏感性。铜绿假单胞菌的外膜对多种抗菌药物如β内酰胺类、i酶抑制剂、i四环素、i氯霉素和喹诺酮类的通透性极低,l而导致先天耐药;也可以通过丢失0prD使亚胺培南不能进入菌体。在沙门菌属、i志贺菌属、i克雷伯菌属、i枸橼酸菌属以及肠杆菌属等细菌中存在着1个多重耐药系统,l称为MAR。其marRAB操纵子可被四环素和氯霉素调节和抑制。产生β内酰胺类、i喹诺酮类和氯霉素等耐药。
铜绿假单胞菌的主动外排系统如MexCD-OprJ、iMexEFOprN、iMexAB-OprM的过量表达,l非选择性主动外排多种抗菌药物如喹诺酮类、iβ内酰胺类、i四环素、i氯霉素等,l与降低外膜的通透性一起产生多重耐药。在其他的细菌体内也存在类似的系统。对四环素的外排主要是通过Tet膜蛋白介导的,l通过方向转运机制把四环素置换出去。链球菌对大环内酯类的耐药可通过mefE和mefA基因编码外排泵。